新型冠状病毒感染住院患者血栓预防和抗凝管理指南 - 中华医学杂志
第一部分 概述
新型冠状病毒感染(corona virus disease 2019,COVID-19)是一种传染性极强的疾病。根据世界卫生组织(WHO)最新数据,截至2023年1月27日,全球已有超过6.65亿COVID-19病例,累积死亡约680万[1]。COVID-19发生后,过度炎症反应可导致肺损伤,包括微血管和内皮功能障碍,续发凝血功能紊乱和血栓形成,在重型与危重型患者中尤其显著[2, 3]。COVID-19可通过多种机制引发血栓并发症,其中静脉血栓栓塞症(venous thromboembolism,VTE)是导致COVID-19住院患者死亡或预后不佳的重要原因之一。作为VTE的两种重要的临床表现形式,肺血栓栓塞症(pulmonary thromboembolism,PTE)和深静脉血栓形成(deep vein thrombosis,DVT)在重症COVID-19住院患者中有很高的发生率[4]。此外,有部分患者即使没有确切的VTE证据,但继发于血液高凝及血管内皮损伤的肺动脉原位血栓形成也会堵塞血管,并造成病情进一步恶化。
自COVID-19流行以来,国内外围绕COVID-19住院患者的凝血紊乱和血栓风险,开展了系列研究,国际相关学术领域也已发表了系列指南,针对COVID-19的血栓预防和抗凝管理提出推荐意见。基于此,中华医学会呼吸病学分会肺栓塞与肺血病学组、中国医师协会呼吸医师分会肺栓塞与肺血管病工作组、全国肺栓塞与肺血管病防治协作组、全国肺栓塞和深静脉血栓形成防治能力建设项目办公室牵头,组织国内VTE防治领域、重症救治领域、循证医学领域等多学科专家共同制订了本指南,以期帮助医务工作者科学、规范地进行COVID-19住院患者的血栓评估、预防、诊疗及管理,有效避免COVID-19住院患者VTE发生,并进一步改善临床预后。
一、指南制订方法
证据和推荐意见分级采用推荐分级的评估、制订与评价(Grading of Recommendations Assessment,Development and Evaluation,GRADE)分级系统(表1、2)[5],由兰州大学循证医学中心/GRADE兰州大学中心提供方法学支持。

点击查看表格
| 推荐强度 | 说明 | 本指南 表达方法 | 推荐强度 表示方法 |
|---|---|---|---|
| 强推荐使用 | 干预措施明显利大于弊 | 推荐 | 1 |
| 弱推荐使用 | 干预措施可能利大于弊 | 建议 | 2 |
| 弱推荐反对使用 | 干预措施可能弊大于利或利弊关系不明确 | 不建议 | 2 |
| 强推荐反对使用 | 干预措施明显弊大于利 | 不推荐 | 1 |

点击查看表格
| 质量等级 | 定义 |
|---|---|
| 高(A) | 非常确信真实值接近观察值 |
| 中(B) | 对观察值有中等程度信心:观察值有可能接近真实值,但仍存在两者不同的可能性 |
| 低(C) | 对观察值的确信程度有限:真实值可能与观察值不同 |
| 极低(D) | 对观察值几乎没有信心:真实值很可能与观察值不同 |
(一)指南制订的方法
指南设计与制订步骤依据2014年《世界卫生组织指南制订手册》[7]以及2022年中华医学会发布的《中国制订/修订临床诊疗指南的指导原则(2022版)》[8]。本指南的报告和撰写参考指南研究与评估系统Ⅱ(Appraisal of Guidelines for Research and Evaluation Ⅱ,AGREE Ⅱ)国际实践指南报告规范(Reporting Items for practice Guidelines in HealThcare, RIGHT)[9]。本指南的整体技术路线见图1。
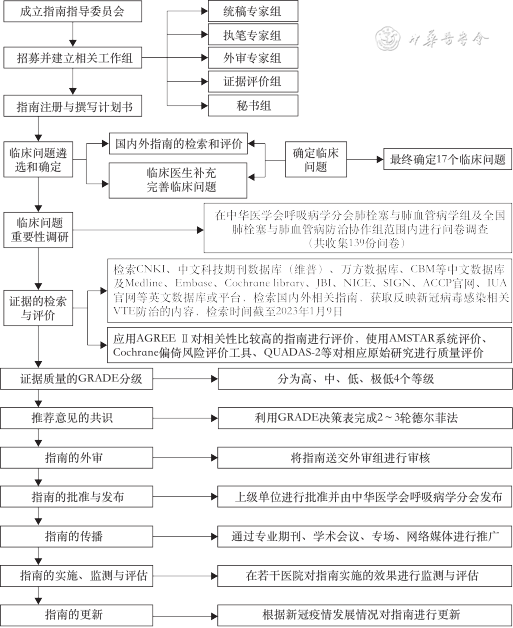
点击查看大图

点击查看大图
本指南工作组应用AGREE Ⅱ[10]对相关性比较高的指南进行评价,作为指南撰写参考。通过筛选,最终纳入指南43部,其中英文指南36部,中文指南7部。4名工作组成员应用AGREE Ⅱ对纳入指南独立进行评价,预实验结果显示4名工作组成员对评分条目的理解一致性较好。经过评价每部指南各领域的得分情况,对每部指南是否推荐使用的结果显示,20部(46.5%)指南被推荐使用,18部(41.2%)被推荐修订后使用,5部(11.6%)不推荐使用。具体见附录[11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53](扫描本文首页二维码可浏览下载)。
(三)指南使用者与目标人群
本指南供内科(呼吸与危重症医学科、重症医学科、心血管科、血液科、肿瘤科等)、外科(血管外科、骨科、普外科、胸外科、心外科等)、妇产科、急诊科、影像科及其他与COVID-19住院患者诊疗和管理相关学科的专业人员使用。指南的目标人群为涉及VTE预防和抗凝管理的COVID-19住院患者。
(四)指南工作组
本指南成立了多学科专家工作组,包括呼吸与危重症医学科、心血管科、血液科、重症监护室(ICU)、血管外科、骨科、肿瘤科、感染科、急诊科、影像科、循证医学等。工作组具体分为5个:执笔专家组、讨论专家组、外审专家组、方法学和证据评价组、秘书组。执笔专家组由具有丰富指南制订经验的VTE领域多学科专家组成,主要职责是确定指南主题和范围,负责指南起草和修订等;讨论专家组对指南推荐意见通过德尔菲法、专家小组会议等达成共识;外审专家组不直接参与指南制订,在前期负责评审指南的评价范围和相关问题,后期负责评审指南定稿文件;方法学和证据评价组为指南评价标准的制订提供意见,明确证据检索、评价方法以及撰写规范;秘书组负责系统地检索已有的临床证据、系统综述并提交给专家组参考,详细记录指南的制订过程等。
(五)利益冲突声明
本指南工作组成员均填写了利益冲突声明表,不存在与本指南撰写内容直接相关的利益冲突。
(六)临床问题遴选和确定
通过系统检索COVID-19与血栓预防及抗凝管理相关领域已经发表的指南和系统评价,以及向全国肺栓塞与肺血管病、VTE专家(139名)共收集了83个临床问题。在中华医学会呼吸病学分会肺栓塞与肺血管病学组、中国医师协会呼吸医师分会肺栓塞与肺血管病工作组(47位专家)范围内进行问卷调查,对临床问题重要性进行1~7分打分。基于调查结果,最终纳入本指南需解决的12个临床问题。
(七)文献检索
(1) 以中文关键词“血栓栓塞、静脉血栓栓塞症、肺血栓栓塞症、深静脉血栓、肺栓塞、预防、抗凝、新冠病毒、奥密克戎、德尔塔”检索中国期刊全文数据库(CNKI)、中文科技期刊数据库(维普)、万方数据库、中国生物医学文献数据库(CBM)等中文数据库;(2)以英文关键词“Thromboembolism、Deep Venous Thrombosis、Pulmonary Embolism/Pulmonary Thromboembolism、VTE、PTE、DVT、Prophylaxis、Prevention、Anticoagulant、Anticoagulation、Anticoagulants、COVID-19、SARS-CoV-2、Corona Virus Disease 2019、Omicron、Delta”系统检索美国国立医学图书馆数据库(Medline)、荷兰医学文摘数据库(Embase)、考克兰图书馆(Cochrane library)、澳大利亚循证卫生保健国际合作中心图书馆(JBI)等英文数据库/平台;(3) 检索国内外相关指南,包括但不限于:中华医学会(CMA)、美国胸科医师学院(ACCP)、美国血液学会(ASH)、美国胸科协会(ATS)、国际血栓形成与止血学会(ISTH)、美国心脏协会(AHA)、美国国立卫生研究院(NIH)、英国国家卫生与临床优化研究所(NICE)、澳大利亚、日本等国家相关权威学术机构出台的指南。对检索到的文献内容进行系统查询和评阅,获取反映COVID-19相关VTE防治的相关内容;遵循“饱和”原则,以继续评阅文献不再能增加新的相关数据为止。
(八)证据评价与分级
方法学和证据评价组使用评估系统评价偏倚风险评价工具(A Measurement Tool to Assess Systematic Reviews,AMSTAR)[54]对纳入的系统评价、Meta分析等进行方法学质量评价,针对随机对照试验(randomized controlled trial,RCT)使用Cochrane偏倚风险评价工具(Risk of Bias,ROB)[55]、针对诊断准确性研究使用诊断准确性研究的质量评价工具(Quality Assessment of Diagnostic Accuracy Studies-2,QUADAS-2)[56],针对队列研究和病例-对照研究使用纽卡斯尔-渥太华文献质量评价量表(Newcastle-Ottawa Scale,NOS)[57]进行方法学质量评价。评价过程由4名证据评价组成员两两一组独立完成并交叉核对,如遇分歧通过讨论或咨询第三方解决。
(九)推荐意见的形成
专家小组基于方法学和证据评价组提供的有关COVID-19住院患者血栓风险评估模型、抗凝预防和管理等安全性和有效性的国内外循证医学证据,讨论组专家、执笔组专家及秘书组经过2轮德尔菲法和3轮视频会议及面对面专家小组会,对推荐意见达成共识,最终形成37项推荐意见。达到以下条件视为达成共识:视频会议及面对面专家小组会中,无专家对推荐意见提出反对;2轮德尔菲法中,专家对推荐意见同意率≥75%视为符合常规德尔菲的验证要求。
本指南推荐内容的主要特点:(1)首次将欧美指南的格式和表述方法与中国临床实际情况结合;(2)COVID-19住院患者血栓预防和抗凝管理策略符合临床实践;(3)重视COVID-19住院患者出院后的随访与管理;(4)充分考虑各类人群情况,系统评价循证医学指南和RCT研究结果,结合临床实践制订推荐意见;(5)关注患者的利益和偏好。
本指南表述特点:(1)清晰显示主题、标题、推荐意见及其说明以解释该条推荐意见;证据总结用以呈现推荐意见的主要证据与来源;(2)单独列出每条推荐意见方便阅读,使用GRADE分级符号、“建议”或“推荐”字样明确区分推荐意见的方向与强度。
(十)指南的批准与发布
指南经多轮专家审核及修订并由上级单位批准,最终由中华医学会呼吸病学分会发布。
(十一)指南的监测与评估
指南发布后,在全国各省随机抽取10~20家不同级别医院,通过定期(每半年~1年)问卷调查等形式监测指南的实施情况,评估指南的实用性、有效性及局限性,根据反馈意见对指南进行进一步修订与更新。
(十二)指南更新
指南工作组计划根据COVID-19疫情的发展情况对本指南进行更新。更新方法按照国际指南更新流程进行[58, 59]。
(十三)传播与实施
指南发布后,指南工作组将主要通过以下方式对指南进行传播与推广:(1)在相关学术期刊发表;同期编写指南详细解读手册;(2)出版与指南相配套的评估、预防和诊疗路径手册,在相关学术会议中进行解读;(3)在国内不同区域、不同学科组织指南推广专场,确保临床医师充分了解并正确应用本指南;(4)通过微信公众号及其他新媒体等多种形式进行推广。
(十四)指南的撰写和外审
各部分初稿确定后,执笔专家组进行指南初稿整合。经讨论专家组审议通过后的指南初稿提交外审专家组进行审阅。根据外审专家组的反馈意见,执笔专家组对初稿进行修改,最后由指南讨论专家组充分论证批准指南的发布。
二、流行病学
关于COVID-19相关的血栓并发症,国内外开展了一系列的流行病学研究,包括脓毒症引起的凝血功能障碍、弥散性血管内凝血(disseminated intravascular coagulation,DIC)、VTE、动脉血栓、微血栓形成和血栓性微血管病等在内的血栓性事件,都可能是导致COVID-19住院患者死亡的重要原因。在所有的血栓并发症中,VTE是最常见的一种临床情况。荟萃分析显示,COVID-19住院患者中VTE患病率为19.0%~59.8%,DVT约为18.1%~69.2%,PTE约为13.5%~27.8%[60]。
在美国一项对COVID-19住院患者的调查分析中,总体COVID-19住院患者与入住ICU患者的VTE发生率显著高于同期非COVID-19住院患者[61]。法国的一项多中心研究纳入1 240例COVID-19住院患者,经CT肺动脉造影(CT pulmonary angiography,CTPA)确诊的PTE发生率为8.3%[62]。英国的研究发现COVID-19住院患者中PTE发生率为5.4%[63]。两项中国队列研究发现,即使接受了预防性抗凝,入住ICU的COVID-19住院患者中DVT的发生率仍高达46%,其中近端DVT的发生率为9%~16%[64, 65]。
国际研究报道,在COVID-19危重症患者中VTE的发生率约为10%~35%,而尸检的病例中VTE的发生率高达60%[66, 67],其中PTE是最常见的血栓性并发症[68]。值得重视的是,这些患者生前并未疑诊或确诊VTE。COVID-19合并呼吸衰竭死亡的患者,其肺组织可见严重的血管内皮损伤、广泛的血栓形成与微血管病变[69, 70]。由此可见,COVID-19住院患者中存在血栓高风险,由于缺乏常规筛查,其发生率可能被显著低估。
三、危险因素与发病机制
任何可引起血液高凝状态、静脉血流淤滞和血管内皮损伤的临床情况均为VTE的危险因素[71],COVID-19住院患者的凝血紊乱同样涉及上述血栓形成三要素(Virchow′s triad),血栓栓子可累及多个组织器官,如肺、心脏、肾脏和大脑,并可造成致残、致死等严重临床后果。
血液高凝是导致COVID-19患者血栓形成的重要因素[72]。新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)刺突蛋白与肺泡上皮细胞表面的血管紧张素转化酶2(angiotensin converting enzyme2,ACE2)结合并导致ACE2活性下调,肾素-血管紧张素-醛固酮系统激活,进一步诱发促炎、促凝及氧化应激反应;病毒感染后机体免疫应答失调,促炎细胞因子导致单核细胞高度表达组织因子并诱发凝血系统激活,抗凝及纤溶系统活性下降。
血管内皮损伤是COVID-19患者血栓形成的另一重要因素。SARS-CoV-2异常激活微血管的补体级联反应,导致细胞因子风暴[71],对血管内皮产生持续性损害。病毒能够刺激内皮细胞持续释放血管性血友病因子(von Willebrand factor,vWF),募集并活化中性粒细胞,释放中性粒细胞胞外诱捕网(neutrophil extracellular traps,NETs),进而促进血栓形成;同时NETs可激活血小板和因子XII[73],进一步加剧机体高凝状态。补体激活也可通过影响凝血系统的动态平衡,进一步加剧血栓的形成。
血流淤滞可加重血栓形成。COVID-19患者可能会出现腹泻、发热、脱水等症状,进一步导致血液浓缩;而活动减少、机械通气、镇静等因素可导致血流减慢;感染本身可能诱发心肌炎、心室功能障碍等均是血流淤滞的重要因素。
重症COVID-19患者VTE风险增加的同时,出血风险也会增加。凝血和纤溶失衡、血小板过度活化、血栓消耗等,会导致凝血因子水平降低、血小板数量减少和/或功能障碍[73, 74];组织缺氧和感染可增加肺泡、消化道、泌尿系等脏器的出血风险[75];高龄、恶性肿瘤、肝肾功能不全、高血压、糖尿病等也是出血风险增加的重要因素[76]。
第二部分 新型冠状病毒感染住院患者的VTE预防和抗凝管理
一、VTE风险评估及出血风险评估
COVID-19住院患者常合并基础疾病[77],尤其是对于年龄>65岁、合并较为严重慢性疾病的患者,如高血压、糖尿病、冠心病、慢性肺部疾病、恶性肿瘤,以及免疫功能低下等都有很高的VTE风险。另外,COVID-19最常累及呼吸系统,重症患者也会出现心脏、肾脏、肠道、神经系统等多个器官或系统并发症,并进一步增加VTE或出血的风险。对患者进行VTE和出血风险的个体化评估至关重要,进行干预时需要权衡疾病的复杂性。
(一)评估人群
对COVID-19患者需重点关注以下人群的VTE及出血风险评估:对于门诊和急诊患者,如有VTE病史及相关危险因素,应尽早评估住院必要性;住院患者应尽早评估,高风险人群尽早给予预防,同时动态评估VTE风险和出血风险,及时调整预防策略;如VTE临床高度可能的患者,应尽早识别,及时行相关检查,明确诊断并尽早给予处理。
(二)动态评估
所有COVID-19住院患者均需全程进行VTE和出血风险的动态评估,并据此判断是否进行个体化预防。患者评估时间节点建议至少为入院后24 h内,病情变化时及出院前24 h内;普通住院患者如出现病情变化,如血氧饱和度下降、呼吸困难加重、D-二聚体>2~4倍正常值上限或进行性升高、下肢肿胀等[45],应根据情况进行VTE风险评估,并注意VTE发生可能;对于危重型患者,应根据情况适当增加评估频率[78]。所有患者出院前需评估VTE和出血风险,以便于出院后VTE的抗凝管理[42]。
(三)风险评估模型
1. VTE风险评估:目前传统的住院患者VTE风险评估模型包括:Padua、Caprini及国际VTE内科预防注册登记(International Medical Prevention Registry on Venous Thromboembolism,IMPROVE)风险评估模型等。在此基础上,针对COVID-19,有学者评价了IMPROVE-DD、新冠修订版Caprini模型的评估效能,同时,验证了3D-PAST模型的风险评估能力[79, 80, 81, 82]。其中IMPROVE-DD已被外部验证,能较好识别COVID-19住院患者高危人群[80];原始和修订版的Caprini评估表预测COVID-19住院患者的VTE具有相似效果[81];Padua模型高分组与COVID-19患者住院不良预后相关[83];3D-PAST模型主要是基于D-二聚体、心率、血压等因素建立,针对COVID-19患者进行了评估,该模型的灵敏度为83%,可帮助COVID-19患者根据VTE风险类别进行个体化预防决策[79]。部分模型不仅可用于VTE风险评估,同时可预测患者不良结局,研究显示,IMPROVE和Caprini评估模型均有助于识别COVID-19住院患者的死亡风险[84, 85]。
2.出血风险评估:理想的出血风险评估模型对于识别与控制COVID-19患者的出血事件发生具有重要价值。基于2022版ACCP指南推荐意见,出血高危因素主要包括:过去30 d内有出血病史,需急诊处理或住院治疗;明确的遗传或获得性出血疾病病史;目前在进行双联抗血小板治疗;近期缺血性脑卒中;颅内出血史;颅内恶性肿瘤;具有出血倾向(如血友病病史);消化道出血史(3个月内);溶栓史(7 d内);硬膜外或脊髓置管;近期大手术(14 d内);或高血压控制不佳[收缩压>200 mmHg(1 mmHg=0.133 kPa),舒张压>120 mmHg];凝血功能异常[国际标准化比值(international normalized ratio,INR)>2.0 或部分凝血活酶时间(activated partial thromboplastin time,APTT)>50 s,血红蛋白<80 g/L,血小板<50×109/L][39]。除以上因素外,同时也应考虑合并用药情况:如果因血栓性疾病或其他原因使用抗凝药物,则无需增加VTE预防;某些抗病毒药物或抗炎药物也有可能增加出血风险,应注意识别。其他的侵入性操作或者手术等也需要注意控制出血风险。
3.平衡VTE和出血风险:随着病情变化,COVID-19患者住院期间的VTE和出血风险亦随之改变,在不同时间点,平衡VTE和出血风险对预防决策非常重要。对于危重症患者,机械通气、中心静脉置管等操作会进一步增加VTE和出血风险,而病情缓解则VTE或出血风险会进一步降低,因此,动态评价两种风险可以精细地指导临床决策[86]。
推荐意见1
(1)对于所有COVID-19住院患者,推荐进行VTE和出血风险评估,并动态平衡两种风险以指导临床决策(1C);
(2)对于所有COVID-19住院患者,动态评估时间节点建议为入院后24 h以内,病情变化时及出院前24 h以内(2C);
“(3)对于因内科疾病急性加重入院的COVID-19患者,建议采用Padua或IMPROVE-DD评估模型;对于外科手术或因创伤入院的患者,建议采取修订版Caprini评估模型;对于单纯因COVID-19住院患者,可考虑采用3D-PAST评估模型(2C)。”
推荐意见说明
以下因素可能会增加COVID-19住院患者VTE风险:D-二聚体水平显著升高或进行性增高(>2~4倍正常值上限);既往有VTE病史;其他明确已知与VTE相关的合并症(如易栓症、恶性肿瘤等)。值得注意的是,出血风险需要进行动态评估,对于可以控制的出血风险,建议给予积极处理。一旦出血风险得到控制,要增强对VTE风险的关注。
二、住院期间的VTE预防和抗凝管理
根据《新型冠状病毒感染诊疗方案(试行第十版)》[77]、《新型冠状病毒感染重症病例诊疗方案(试行第四版)》[87],COVID-19患者分为轻、中、重和危重型,其中重型和危重型界定为重症病例;对于以下任何一种情况:年龄>65岁、未完成全程疫苗接种、合并较为严重慢性疾病,即使没有达到重症病例诊断标准,如果出现COVID-19导致的肺炎,也应按照重症病例管理。在临床实践中,应针对COVID-19住院患者多器官系统进行综合性干预和管理,并根据不同严重程度进行VTE和出血风险评估,采取相应的预防措施。
(一)轻、中型COVID-19住院患者
1.轻、中型COVID-19定义及住院患者VTE风险:轻型COVID-19患者以上呼吸道感染为主要表现,如咽干、咽痛、咳嗽、发热等。中型COVID-19患者会表现为持续高热>3 d或(和)咳嗽、气促等,但呼吸频率<30 次/min、静息状态下吸空气时指氧饱和度>93%。影像学可见特征性SARS-CoV-2感染肺炎表现。上述患者一般情况下VTE风险较低,但是,如果出现高热、脱水、腹泻等症状会导致血容量不足及血液浓缩,VTE风险可能增加。
2.轻、中型COVID-19住院患者抗凝管理:轻、中型COVID-19患者通常无需住院治疗,但一部分轻、中型COVID-19患者可能出现因基础疾病加重或接受手术治疗住院,这部分患者住院后其VTE风险会增加,应按照常规住院患者的VTE预防策略实施抗凝管理。研究发现,因轻、中型COVID-19住院的急性病患者发生VTE的风险比因其他急性感染或肺炎住院的内科疾病患者高3倍[88, 89]。因此,合并基础疾病或接受手术治疗后轻、中型COVID-19患者具有较高VTE风险,并且可能转为重型或危重型,临床应给予关注,应尽早启动风险评估:如果明确VTE高风险,出血低风险,推荐应用预防剂量低分子量肝素(low molecular weight heparin, LMWH)/普通肝素(unfractionated heparin, UFH)或磺达肝癸钠。
对于有出血风险的COVID-19患者,如果有较高VTE风险,建议使用机械预防,如间歇充气加压泵(intermittent pneumatic compression, IPC)、足底静脉泵(foot vein pumps, VFPs)或梯度压力袜(graduated compression stockings, GCS)等。
推荐意见2
(1)对于因内科疾病急性加重入院的轻、中型COVID-19患者,如果明确VTE高风险,且出血低风险,推荐使用预防剂量的LMWH/UFH(1B);
(2)对于拟行外科手术轻、中型COVID-19住院患者,如VTE高风险、且出血低风险人群推荐使用预防剂量的LMWH/UFH(1B);
“(3)对于因内科疾病急性加重或外科手术入院的轻、中型COVID-19患者,如果明确VTE高风险,且出血高风险,建议使用机械预防,如IPC或GCS等(2C)。”
推荐意见说明
轻、中型COVID-19患者一般不需要住院,如果因内科疾病急性加重、创伤或其他原因需要外科手术住院治疗,其VTE风险会增加,应按照常规住院患者的VTE预防策略实施。
(二)重型COVID-19住院患者
1.重型COVID-19定义及住院患者VTE风险:符合以下情况之一(并未达到收住ICU的标准):(1)呼吸窘迫,呼吸频率≥30次/min;(2)静息状态下,吸空气时指氧饱和度≤93%;(3)动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg;(4)临床症状进行性加重;(5)肺部影像学显示24~48 h内病灶明显进展>50%定义为重型COVID-19患者。
重型COVID-19患者常存在急性感染、制动、呼吸衰竭、D-二聚体升高以及其他合并症,为VTE高风险[90]。重型COVID-19患者VTE风险是其他疾病住院患者的3~6倍[91];荟萃分析显示,重型COVID-19患者VTE并发症发生率约为17.2%[92]。同时,预防性抗凝不充分会导致COVID-19患者死亡率增加[93],即使在进行了标准的预防性抗凝后仍有高达7.9%的患者发生VTE[89],目前国际上已针对该问题开展多项临床研究。
2.重型COVID-19住院患者抗凝管理:对于重型COVID-19住院患者,适合的抗凝药物剂量选择是亟待解决的问题。基于近期RCT研究和荟萃分析结果,与预防剂量相比,治疗剂量似乎更能使患者获益,如降低重型COVID-19患者死亡风险,减少对高级生命器官支持需求[94]。这些研究均排除了高出血风险人群,因此可能低估治疗剂量抗凝患者大出血风险。另外,有两项研究表明使用治疗剂量抗凝并没有改善临床结局[95, 96]。尽管制订方法和推荐意见存在差异,在抗凝剂量方面,多数国际权威学术机构的新近指南建议重型COVID-19患者使用治疗剂量抗凝[34, 37, 39, 46, 97],有少数国家COVID-19指南工作组[36]建议使用中等剂量/预防剂量抗凝。
综合以上研究结果,对于大多数重型COVID-19患者,建议尽早启动风险评估和预防:如无VTE病史,无D-二聚体显著升高,病情相对稳定,出血低风险(参见前文),推荐应用预防剂量LMWH/UFH或磺达肝癸钠。药物预防时间应持续14 d或危险因素去除。对于存在VTE高风险(D-二聚体水平显著升高或进行性增高、既往VTE病史、其他明确已知与VTE相关的合并症,参见前文)、出血低风险的重型COVID-19患者,推荐治疗剂量LMWH/UFH[39, 46],用药剂量需结合患者具体情况进行调整。应尽早判断重型COVID-19患者是否已发生VTE,如高度疑诊或确诊,需尽早启动VTE的危险分层与管理,并遵循相应指南推荐意见[98, 99]。
LMWH由肾脏清除,重度肾功能不全者慎用,若应用则需减量并监测血浆抗Ⅹa因子活性(anti-FⅩa)。对于严重肾功能损害(肌酐清除率<30 ml/min)的患者,建议使用UFH[23, 100]。此外,在VTE预防过程中注意观察抗凝药物使用后是否有出血或凝血功能异常,如出现应先停药并做相应处理[101],并根据出血风险变化动态调整预防手段。关于抗血小板药物,两项RCT研究提示P2Y12抑制剂或阿司匹林与治疗剂量肝素联用后不能增加无器官支持天数或降低死亡率[20, 21],基于潜在的出血并发症,对于重型COVID-19住院患者,不推荐在抗凝基础上联用抗血小板药物作为VTE的预防[102]。
推荐意见3
(1)对于重型COVID-19住院患者,如果出血低风险,推荐初始使用预防剂量的LMWH/UFH抗凝(1B);
(2)对于重型COVID-19住院患者,如果明确VTE高风险、出血低风险,且病情有加重趋势(如D-二聚体进行性增高、低氧血症加重等),推荐使用治疗剂量的LMWH/UFH抗凝(1B);
“(3)对于重型COVID-19住院患者,如果明确出血高风险,建议机械预防,在出血风险降低后,及时进行药物预防或联合机械预防(2C)。”
推荐意见说明
重型COVID-19患者可能出现凝血功能异常、多脏器(如肺脏、心脏、肾脏)存在微血栓形成。脏器微血栓可能加剧病情,而D-二聚体能在一定程度上反映微血栓形成情况,因此其动态监测是评估病情变化的重要方法。如患者出现D-二聚体明显升高,或进行性增高,或两者兼有,如无抗凝禁忌,可给予治疗量抗凝。
(三)危重型COVID-19住院患者
1.危重型COVID-19定义及住院患者VTE风险:符合以下情况之一:(1)出现呼吸衰竭,且需要机械通气;(2)出现休克;(3)合并其他器官功能衰竭需入住ICU监护治疗被定义为COVID-19危重型患者。一般为ICU患者。COVID-19危重型患者存在大量VTE危险因素,除SARS-CoV-2外,患者合并基础疾病、心衰、电解质紊乱、低氧血症、活动受限、机械通气、激素治疗等因素均可进一步增加VTE风险[103, 104]。
2.危重型COVID-19患者预防性抗凝管理:关于危重型COVID-19患者的抗凝指征并无太多争议,如果没有禁忌证,均应该考虑实施VTE预防。COVID-19住院患者常出现大血管和微血管血栓形成和炎症反应,通常与不良临床结局相关。在实践中,尽管采用了标准抗凝预防,仍有22.7%的患者发生VTE[89],危重型COVID-19患者同时面临出血风险,当存在明显肺部炎症时,更高剂量抗凝可能加剧肺泡出血,导致更坏的结局。全球已开展多项研究,综合评价不同剂量抗凝对危重型COVID-19患者VTE及出血事件的净获益,多数研究支持对于无抗凝禁忌的危重型COVID-19患者使用预防剂量抗凝。需要强调的是,部分COVID-19患者在ICU早期即并发VTE,应重视早期筛查,若确诊合并VTE,建议使用治疗剂量抗凝。
对于低出血风险的危重型COVID-19患者,推荐首选LMWH[105]。有研究探讨了使用中等剂量LMWH相较于预防剂量未能明显改善危重型COVID-19患者短期及长期主要结局[106, 107];另一项研究也证实了预防剂量和中等剂量依诺肝素在改善VTE结局方面无显著差异[108]。相对于预防剂量,治疗剂量抗凝在降低危重型COVID-19患者死亡率方面没有显著优势,反而增加大出血风险[109, 110],荟萃分析的结果也支持这一结论[111]。综上,中等剂量和治疗剂量的抗凝决策对危重型患者并无获益[112],预防剂量抗凝更适合于危重型COVID-19患者的VTE预防。
对于合并高出血风险的危重型COVID-19患者,在积极纠正潜在出血因素的基础上,应同时进行机械预防,比如IPC、VFPs等。危重型COVID-19患者常处于卧床状态,若其卧床超过72 h,使用IPC前建议行双下肢静脉超声排除DVT,防止新形成的血栓脱落导致PTE。此外,IPC每日使用时间应该在18 h以上。机械预防时间应该贯穿于整个ICU收住期间,或直至去除危险因素。在此期间注意动态监测患者出血风险,出血风险降低后应及时进行药物预防联合机械预防。
推荐意见4
(1)对于危重型COVID-19患者,如果无抗凝禁忌证,推荐进行药物预防(1C);
(2)对于危重型COVID-19患者,如果没有疑似或确诊VTE的证据,推荐采用预防剂量LMWH/UFH,直至患者降为VTE低风险(1B);
“(3)对于危重型COVID-19患者,如果出血高风险,建议进行机械预防,首选IPC或VFPs,在出血风险降低后,及时进行药物预防联合机械预防(2C)。”
推荐意见说明
建议采取预防措施前对患者进行全面评估,结合患者临床情况制订适合的预防策略。预防抗凝前应进行全面的包括基础疾病、实验室检查、合并用药及侵入性操作在内的评估。建议预防抗凝期间动态评估COVID-19危重型患者VTE风险,同时动态评估患者出血风险。但是迄今为止,尚无理想的出血风险评估模型在此类患者中得到验证。对于COVID-19危重型患者,如果无疑似或确诊VTE的证据,不推荐使用中等剂量预防性抗凝。
(四)特殊人群的血栓预防与抗凝管理
1.妊娠合并COVID-19的预防抗凝策略:妊娠期和产褥期VTE风险分别是非妊娠妇女的5倍及30~60倍[113]。妊娠女性若罹患COVID-19,病情更易进展,尤其是在妊娠晚期。与孕产妇危重型COVID-19相关危险因素包括:年龄≥35岁(OR=1.56)、体质指数(BMI)≥30 kg/m2(OR=1.84)、合并慢性高血压(OR=1.75)、合并糖尿病(OR=2.90) [114, 115]。妊娠合并COVID-19患者疾病严重程度与VTE发生率相关[116]。感染COVID-19后早产风险(RR=4.05)、初产妇发生子痫前期的风险(RR=6.26)明显增加。对于妊娠期合并COVID-19者,应进行VTE风险动态评估,同时警惕其他产科并发症。铁蛋白、C反应蛋白及D-二聚体常在COVID-19患者中升高,并不能作为妊娠期VTE的风险预测指标。胎盘中检测出SARS-CoV-2的产妇可能发生DIC,血小板和纤维蛋白原水平低,伴/不伴PT和/或APTT延长。
如孕产妇合并COVID-19,LMWH较UFH更适合于预防VTE[117]。建议所有患者均进行VTE和出血风险评估,如果评估VTE高风险、出血低风险患者,如无预期24 h内分娩,建议使用预防剂量LMWH;对于病情有加重趋势(如D-二聚体进行性增高、低氧血症加重等)的重症COVID-19孕产妇,建议使用治疗剂量LMWH/UFH。如患者突然出现胸痛、缺氧加重或呼吸频率超过20次/min或COVID-19恢复后呼吸困难持续或加重,考虑PTE或心力衰竭时,可完善心电图、超声心动图、CTPA、肺通气灌注显像等检查以明确诊断。妊娠期进行含放射线的检查前应取得患者知情同意。一旦高度疑诊或确诊VTE,应尽早启动治疗。
推荐意见5
(1)对于所有确诊或疑似COVID-19孕产妇,均需要进行VTE和出血风险评估,酌情使用预防剂量LMWH,有严重COVID-19并发症者,抗凝剂量需个体化(2C);
(2)对于重症COVID-19孕产妇,如果明确VTE高风险、出血低风险,且病情有加重趋势(如D-二聚体进行性增高、低氧血症加重等),建议使用治疗剂量的LMWH/UFH(2C);
“(3)对于产后6周内确诊COVID-19者,建议充分评估VTE风险;对于VTE高风险或风险持续存在者,可以考虑延长抗凝时间(2C)。”
推荐意见说明
COVID-19感染越重,妊娠期VTE发病率越高,但与轻度或中度感染的关系尚不明确。建议对COVID-19的孕产妇加强宣教,做好一级预防。对于妊娠晚期的孕产妇还要考虑积极的多学科会诊,必要时终止妊娠。
关于孕产妇的出血风险,除了注意常规出血危险因素外,还需注意预计在24 h内分娩或产科相关出血风险。大多数COVID-19患者血小板计数正常甚至升高,但部分患者血小板减少与COVID-19有关。当血小板计数低于50×109/L时,应注意血小板减少原因,必要时停止妊娠期间的LMWH。对于VTE高风险、在妊娠期间或产后6周内确诊COVID-19的女性,建议出院后进行至少10 d的抗凝预防。对于部分VTE极高风险者,建议抗凝延长至产后6周或者危险因素去除。
2.肿瘤合并COVID-19患者的预防抗凝策略:COVID-19合并肿瘤患者VTE风险增加[3],有荟萃分析示,入住普通病房或ICU的肿瘤合并COVID-19患者VTE发生率分别为7.1%和27.9%[118]。另一项荟萃分析发现,妇科肿瘤患者术前药物预防可降低术后VTE风险[119]。既往有VTE病史的危重型COVID-19患者在三个月内接受过抗肿瘤治疗,VTE风险进一步增加。因此,对于肿瘤合并COVID-19的住院患者,需重新筛查和评估VTE。基于目前证据,VTE预防方式同未罹患肿瘤患者。
对于使用抗肿瘤药物治疗的肿瘤住院患者,有研究将患者随机至LMWH组(40 mg每日1次)或据体重调整的LMWH组(1 mg/kg每日1次)[120],均未观察到症状性VTE或出血事件,建议肿瘤合并COVID-19的患者使用预防剂量LMWH或磺达肝癸钠进行VTE预防,不推荐常规使用直接口服抗凝药(direct oral anticoagulants,DOACs)作为住院肿瘤患者合并VTE的预防药物。对于门诊患者,可使用Khorana评分评估院外VTE风险,相关研究和荟萃分析表明,包括门诊化疗、VTE高风险且出血低风险的门诊肿瘤患者,使用LMWH或DOACs可降低患者VTE风险且不增加大出血风险[41, 121]。因抗肿瘤治疗或外科手术后合并COVID-19,VTE风险会进一步增加,如果病情加重,D-二聚体进行性增高,低氧血症加重,应完善相关检查,除外VTE可能。
对于内科治疗的肿瘤住院患者,如果合并COVID-19,同时合并出血高风险,可考虑应用机械预防。一项对肿瘤术后患者进行的荟萃分析提示,IPC联合LMWH是预防VTE的最佳方法[122]。但是,下腔静脉滤器的使用暂无新研究数据支持。因此,除非存在出血高风险,在住院期间不建议将机械预防作为单一预防或将下腔静脉滤器用于常规预防。
推荐意见6
(1)对于需内科治疗的住院肿瘤患者,如果合并COVID-19,在住院期间推荐使用预防剂量的LMWH或磺达肝癸钠,出院后的预防建议参照常规指南的推荐意见(1B);
(2)对于正在接受系统抗肿瘤治疗的COVID-19患者,如果出院前评估VTE高风险、出血低风险,出院后可更换为直接口服抗凝药物(1B);
“(3)对于因COVID-19住院的恶性肿瘤患者,如确诊VTE,建议使用治疗剂量的LMWH/UFH。出院后的治疗建议参照相关指南的推荐意见(2B)。”
推荐意见说明
基于肿瘤专科指南,肿瘤患者一旦感染COVID-19,一般会延迟抗肿瘤治疗10~14 d,因此在院外需警惕发生VTE,出现下肢肿胀、低氧血症、呼吸困难加重时应及时就医,明确是否合并VTE;如在抗肿瘤治疗周期中感染COVID-19,可能会病情加重而入院,此时出血风险也会随之增加,因此应关注抗肿瘤药物与抗凝药物的相互作用。对于消化道、泌尿系肿瘤患者,院外抗凝时注意出血风险,首选LMWH。对于COVID-19住院患者,如果出院前评估需要院外预防,推荐延长抗凝时间,VTE高风险患者可延长35 d或者直至危险因素去除。
3.基础疾病对抗凝策略的影响:对于呼吸系统疾病、心血管疾病、糖尿病、慢性肝肾功能不全等基础疾病患者,特别是老年人群,会增加对COVID-19的易感性。某些风湿免疫性疾病、恶性肿瘤、器官移植合并使用免疫抑制剂的患者,更易出现COVID-19相关并发症。老年人及伴有严重基础疾病的COVID-19患者在住院期间重症率高于一般人群,如果合并侵入性操作,更易发生VTE及不良事件,死亡风险会进一步增加[77]。
COVID-19的死因60%~90%可归因于呼吸系统疾病和心血管疾病合并症[123, 124]。尸检数据表明,包括PTE在内的约60%~100%的血栓事件可能被漏诊,表明血栓机制对患者死亡产生重要影响[66, 125],因此,对患者应进行VTE与出血风险综合评估并进行及时预防以改善患者预后。对合并心血管疾病的COVID-19患者应用抗凝药物和恰当的抗栓管理可提高COVID-19住院患者生存率。血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitors,ACEI)/血管紧张素受体拮抗剂(angiotensin receptor blockers,ARB)和治疗性抗凝与COVID-19不良临床结局无关,不建议COVID-19患者停止正在使用的心血管药物[126]。
免疫失调和/或正在接受免疫抑制治疗的患者会增加COVID-19易感风险[127]。包括结缔组织疾病(connective tissue diseases,CTD)在内的免疫性疾病患者,常使用免疫抑制剂、糖皮质激素、抗病毒药物等,合并COVID-19后应用DOACs可能影响其血药浓度和抗凝活性,可更换为LMWH/UFH,目前,尚无确切证据支持在器官移植等使用免疫抑制剂患者中调整抗凝药物剂量。需注意,LMWH/UFH与非甾体类解热镇痛药、右旋糖酐等联用可能抑制血小板功能,增加出血风险。除了药物影响,CTD往往会合并极端体重、严重血小板减少、肝肾功能不全等情况,应酌情进行剂量调整。
推荐意见7
(1)对于所有COVID-19住院患者,在实施VTE抗凝预防措施前需全面评估患者基础疾病、实验室检查(包括肝肾功能、凝血功能等)、合并用药及侵入性操作等。建议预防抗凝期间动态评估患者VTE风险和出血风险(2C);
(2)对于COVID-19住院患者,经常合并基础疾病,可能出现基础疾病加重,合并用药与抗凝药物之间会存在相互作用,建议根据具体情况调整抗凝药物剂量(2C);
“(3)对于风湿免疫性疾病或器官移植后合并使用免疫抑制剂的患者,一旦合并COVID-19,建议给予预防剂量LMWH/UFH(2C)。”
推荐意见说明
对于存在肝肾功能不全的患者,应该注意代谢因素对抗凝药物的影响。对于心血管疾病的患者,应注意某些抗血小板药物与抗凝药物的协同作用,需要酌情调整抗凝药物剂量,降低出血风险。
4.服用抗病毒及抗炎药物患者的血栓预防与管理策略:抗病毒药物奈玛特韦/利托那韦(Paxlovid)用于治疗轻、中型COVID-19成年患者,以减少发展为重症的风险[128, 129]。利伐沙班、阿哌沙班和达比加群酯可能与Paxlovid发生药物相互作用(drug-drug interaction, DDI),增加出血风险,不建议联用,可更换为胃肠外抗凝药。维生素K拮抗剂可被利托那韦抑制或诱导[130],华法林使用期间应注意监测INR(表2)。此外,利托那韦可能导致氯吡格雷抑制血小板聚集不足[131]。
在Paxlovid使用期间,应对无法停用且会与之产生DDI的药物进行剂量调整,比如免疫抑制药(immunosuppressive drugs,ISDs)、抗炎药。移植患者终身接受ISDs治疗,其药效学和药代动力学可受到抗病毒药物的影响。Paxlovid与抗高血压药比如ACEI/ARBs等无DDI,联用时可不进行剂量调整[129]。此外,阿兹夫定[132]、莫诺拉韦[133]、恩适得[134]等药物目前与抗凝药物相互作用证据暂缺,需进一步研究。
推荐意见8
(1)对于COVID-19住院患者,如果需要使用抗病毒治疗(如Paxlovid),推荐将抗凝药物更换为LMWH或UFH(1C);
(2)对于COVID-19住院患者,应评估使用抗病毒药物的风险-获益,同时动态监测药物间相互作用对抗凝管理策略的影响(2C);
“(3)对于COVID-19住院患者,如果使用抗炎药物,应注意抗炎药物本身会增加VTE和出血风险,建议动态监测VTE及出血不良事件的发生,并根据情况调整抗凝药物剂量(2C)。”
推荐意见说明
对于已确诊VTE患者,在使用抗病毒药物期间建议更换为治疗剂量LMWH/UFH。对于有VTE风险的COVID-19患者,在使用抗病毒药物期间建议应用预防剂量的LMWH/UFH。目前Paxlovid推荐连续使用5 d,在最后一剂量Paxlovid给药结束后,大多数DDI可在2~3 d内消失,老年患者需要的时间可能略有延长。在此期间,可使用LMWH/UFH进行过度治疗。
巴瑞替尼是一种口服的选择性酪氨酸激酶1/2(Janus Kinase1/2,JAK1/2)抑制剂,有研究表明,接受巴瑞替尼治疗的患者发生VTE和视网膜动脉闭塞概率增加。托珠单抗可特异性结合并抑制IL-6的可溶性和膜结合受体,降低IL-6的促炎作用,有研究显示该药可能会增加患者出血风险。因此,在应用这些抗炎药物过程中,应注意调整抗凝药物剂量。糖皮质激素既可加重VTE风险,也可增加出血风险,临床实践中应充分评估VTE及出血风险。
5.COVID-19合并血小板减少患者抗凝干预问题:重型及危重型COVID-19患者常出现血小板减少,需对引起血小板减少疾病进行鉴别,如脾功能亢进、血液系统疾病、骨髓增生异常综合征、甲状腺功能亢进、抗磷脂综合征等。
使用肝素类药物也可能会引起肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT)[135]。一般在患者使用LMWH或UFH后5~7 d出现血小板计数迅速下降,不能用其他病因解释时可考虑HIT,确诊需查HIT抗体及4Ts评分。4Ts评分是评估HIT临床可能性的有效工具,若为低度临床可能性,需寻找其他导致血小板减少的原因;若为中度及高度临床可能性,推荐检测HIT抗体,抗体阴性可除外HIT,IgG特异性抗体阳性时结合临床可确诊。
对于合并血小板计数减少或应用肝素期间出现HIT患者,推荐应用其他抗凝药,如阿加曲班、比伐芦定、磺达肝癸钠、利伐沙班等。鉴于HIT后VTE风险高,对于孤立HIT患者,建议应用非肝素类抗凝药至少1个月,监测血小板数量恢复并稳定于基线水平。
推荐意见9
(1)对于COVID-19合并血小板减少患者,首先要评估血小板减少的病因。如果没有肝素类药物使用史,应该考虑与基础病或病毒感染有关,应积极治疗原发病,必要时输注血小板(2C);
“(2)如果近期内使用LMWH/UFH,应采用4Ts和(或)HIT抗体进行排除诊断和鉴别诊断,如高度疑诊或确诊HIT,可将抗凝药物更换为阿加曲班或比伐芦定等(2C)。”
推荐意见说明
急性血栓形成也可以引起消耗性血小板下降,应尽早明确诊断,注意鉴别,及时处理。是否需要输注血小板要根据血小板减低的程度决定,当血小板计数小于2万时,可考虑输注血小板。
三、出院后的VTE预防和抗凝管理
出院后部分COVID-19患者仍存在高凝状态(高D-二聚体)[136]和持续的炎症反应(高C-反应蛋白)[137],可能会增加VTE和出院后死亡的风险。有研究发现,COVID-19患者出院后VTE及出血发生率显著升高,与非流行期比较,在流行期间,COVID-19发病后第1周和第2周首次PTE发病率分别增高36.17和46.4倍,在COVID-19发病后30日内,对潜在混杂因素的影响进行校正后,DVT、PTE和出血的发病率分别增加4.98、33.05和1.88倍;危重型COVID-19患者VTE风险更高[76]。
COVID-19患者出院后是否进行延长抗凝预防仍存争议。在最近一项RCT研究中,COVID-19患者出院前进行VTE风险评估,针对具有VTE高风险的COVID-19患者(IMPROVE评分≥4分,或IMPROVE评分2~3分且出院时D-二聚体>500 ng/ml),出院时被随机分配为利伐沙班组(10 mg,每天1次)和安慰剂组,平均疗程35 d,证实对于出院时具有VTE高风险人群,利伐沙班每日10 mg的抗凝预防可减少不良结局的发生,两组患者均未出现大出血事件[138]。另一项RCT提示在危重型COVID-19患者中,抗血小板药物治疗没有显示出理想的预防效果[139]。
推荐意见10
(一)出院后的延长预防抗凝
(1)对于COVID-19住院患者,如果出院前评估VTE高风险,且出血低风险,推荐进行药物预防,可选用直接口服抗凝药物(1B);
(2)对于COVID-19住院患者,如果出院前评估VTE高风险,且出血高风险,建议使用机械预防(如GCS)或早期活动(2C);
“(3)对于COVID-19住院患者,如果出院前评估需要院外预防,根据VTE风险,延长预防时间,或直至危险因素去除(2C)。”
(二)出院后随访与健康管理
(1)对于所有出院的COVID-19患者,建议出院后进行严密随访,需要关注VTE风险、出血风险及VTE相关症状(2C);
“(2)对于所有出院的COVID-19患者,建议对VTE高风险患者进行抗凝用药指导,密切观察药物相互作用及抗凝相关并发症(2C)。”
推荐意见说明
鉴于COVID-19患者VTE高风险,部分患者在出院前仍有残余症状,建议在出院前进行相关评估并复查D-二聚体。如果D-二聚体仍然升高,需除外VTE事件的发生。若无VTE事件,出院前符合以下标准,应判断存在VTE高风险:Padua评分≥4分,或IMPROVE评分≥4分,或IMPROVE评分2~3分同时出院时D-二聚体升高>2倍正常值。考虑到药物应用的方便性,对于VTE高风险人群出院后可使用直接口服抗凝药物,如利伐沙班片每日10 mg,每日1次。
对于COVID-19住院患者,如果出院前评估VTE低风险,不建议对所有出院患者进行常规VTE药物预防。针对高VTE风险人群需要加强出院后患者的抗凝管理,以期获得更好的临床结局。COVID-19患者出院后2周~3个月需动态复查;随访方式包括电话、微信、网络或门诊访视等,并关注VTE相关症状如胸闷、呼吸困难等,一旦高度怀疑VTE,应尽快到医院就诊并完善相关检查。
四、合并VTE住院患者的抗凝管理
部分重型/危重型COVID-19患者早期即可并发VTE,应重视早期筛查,若确诊VTE,尽早启动治疗剂量抗凝。对于已明确VTE的患者,部分正在抗凝治疗、部分已进入延展期抗凝或已停药,如果并发COVID-19,应根据不同的临床情况进行抗凝方案调整。
(一)COVID-19患者住院期间并发VTE的抗凝管理
COVID-19住院患者存在很高的血栓风险,其中以VTE最为常见。对于存在VTE高风险的患者,如果出现DVT或PTE疑似症状时,应尽早进行临床可能性评估和D-二聚体检查,必要时行下肢静脉超声和(或)CTPA检查以进一步明确诊断。对于确诊的VTE患者,可参照相关诊疗指南进行诊治。
推荐意见11
(1)对于因COVID-19住院的患者,如高度疑诊DVT或(和)PTE,应尽快完善检查,明确诊断,如果没有禁忌证,应尽早启动抗凝治疗,推荐使用治疗量LMWH/UFH(1C);
(2)对于因COVID-19住院的患者,如确诊PTE,应该根据血流动力学变化进行疾病严重程度的危险分层,危险分层与临床管理方案与非COVID-19患者一致(1C);
“(3)对于COVID-19合并急性VTE的患者应进行规范抗凝治疗,在急性期或住院早期推荐初始抗凝选择皮下注射LMWH、静脉注射UFH或皮下注射磺达肝癸钠(1C)。”
推荐意见说明
COVID-19患者经常有呼吸困难、气短、胸闷、低氧血症等表现,会掩盖急性PTE的症状,因此应动态监测D-二聚体,如D-二聚体显著升高且与原发病病情不符,应尽快行下肢静脉超声检查和CTPA以明确诊断。对于COVID-19合并急性VTE的患者进行规范抗凝治疗,考虑到药物的相互作用,在急性期或早期不建议使用口服抗凝药物,如华法林或DOACs,在后期无需使用抗病毒治疗药物的情况下,可选择使用DOACs作为长期治疗方案。
对于高危PTE患者,在启动溶栓或介入治疗之前,建议优先选择静脉注射UFH抗凝治疗。对于COVID-19合并急性VTE的患者,在COVID-19病情相对稳定后,可考虑将抗凝治疗方案调整为口服抗凝药物。对于COVID-19合并偶然发现的VTE、孤立的VTE、肌间静脉血栓,建议住院期间应用治疗剂量LMWH/UFH,并根据患者年龄、肝肾功能状态及出血风险进行调整,出院后可切换为治疗剂量的口服抗凝药物,抗凝疗程至少3~6个月。
(二)已明确诊断并正在进行VTE的治疗、合并COVID-19的住院患者
COVID-19常伴发凝血功能异常,特别是多脏器出现微血栓形成,导致病情加重。因此,对于既往有VTE的患者,且规律应用抗凝药物的患者,如无新发出血或出血高风险,建议继续应用当前的抗凝治疗药物,并动态监测血浆D-二聚体水平,如在应用抗凝药物情况下, D-二聚体水平明显增高、进行性增高或两者兼有,可考虑调整用药或适当增加抗凝治疗强度,并需关注不同药物之间的相互作用。
推荐意见12
(1)对于已确诊VTE且规律应用抗凝药物的患者,因轻、中型COVID-19住院治疗,如无新发出血或出血高风险,且无需抗病毒治疗,建议继续应用当前抗凝治疗药物(2C);
(2)对于已确诊VTE且规律应用抗凝药物的患者,因COVID-19住院治疗,如检测D-二聚体水平进行性增高,应除外VTE复发可能,如无出血风险,建议恢复初始诊断时的抗凝治疗强度(2C);
“(3)对于已确诊VTE且规律应用抗凝药物的患者,因COVID-19住院治疗,需要抗病毒或其他支持治疗,如并存VTE复发高风险,建议将口服抗凝药物更换为治疗剂量的LMWH/UFH抗凝(2C)。”
推荐意见说明
对于部分明确的VTE患者,如果进入延展期抗凝,抗凝剂量可能会减半,此类患者如果面临着COVID-19加重、D-二聚体增高时,应除外VTE复发可能,需进一步检查寻找复发证据,同时将抗凝药物恢复为治疗剂量的LMWH/UFH。对于既往存在VTE,并已完成规范抗凝治疗的患者,如已停用抗凝药物,因COVID-19住院治疗,建议重新评估VTE复发风险;对于存在VTE复发高风险的患者,建议在住院期间给予治疗剂量的LMWH抗凝,出院后可切换为口服抗凝药物;对于存在VTE复发低风险的患者,建议在住院期间根据COVID-19的严重程度给予恰当剂量的LMWH抗凝。
五、COVID-19疫情常态化形势下VTE防治的质量评价与控制
COVID-19疫情逐渐成为常态化趋势,绝大多数住院患者都有合并COVID-19的情况,医院内VTE的发生风险有增无减。在应对疫情的同时,VTE的防治压力显著增加。质量评价与控制是促进临床医务人员规范合理进行动态评估与落实防治措施的重要途径,借助信息化质控手段,可有效提高VTE评估和预防的内涵质量。在临床实践及管理的过程中,需重点关注三类核心质量指标:评估质量指标,预防质量指标,结局质量指标[86]。
(一)评估质量指标
COVID-19住院患者评估质量指标,主要包括VTE风险评估率、VTE中高风险比例;出血风险评估率、出血高风险比例。其中,VTE风险评估率和出血风险评估率均应注意不同动态时点是否进行了评估,如入院后24 h内、病情变化时、出院前24 h内等关键动态时点。关注“VTE中高风险比例”对于判断VTE评估的内涵质量具有重要意义,特别是COVID-19疫情常态化形势下,需要对VTE中高风险比例以及出血高风险比例标准进行调整。
(二)预防质量指标
COVID-19住院患者预防质量指标,主要包括药物预防实施率、机械预防实施率、联合预防实施率。其中药物预防是最关键的核心指标,需要基于COVID-19的不同临床分型,在准确评估VTE风险和出血风险的基础上,对VTE规范预防的剂量和疗程进行界定,并做到动态评估,及时调整预防策略。重点关注抗凝药物的种类、剂量、疗程及出院带药医嘱是否规范合理。
(三)结局质量指标
COVID-19住院患者结局质量指标,主要包括医院相关性VTE的检出率、规范治疗率、出血事件发生率和死亡率。在COVID-19疫情常态化的形势下以及临床医师对VTE认知的提升,医院相关性VTE的检出率会有显著增加的可能,但随着规范治疗的实施,出血事件的发生率应有所下降。而医院相关性VTE的死亡率会因重型和危重型COVID-19患者比例的增加而出现上升的可能,相应的标准应根据实际情况进行调整。
第三部分 结语
一、亟待解决的问题
自SARS-CoV-2感染流行以来,国内外针对COVID-19患者的血栓风险开展了系列研究,国际学术领域也针对COVID-19的血栓预防和抗凝管理更新了相关指南[39, 44, 46],但仍有很多亟待解决的疑点和难点问题,如:COVID-19患者的血栓和出血风险评估模型的开发及验证;不同的SARS-CoV-2变异毒株对血栓形成风险的影响;不同类型抗凝药物及不同剂量对血栓形成的发生率、死亡率、出血事件发生率以及患者结局的影响;抗凝预防对不同种族COVID-19患者的血栓形成和出血结局的影响;COVID-19中、重型和危重型患者血栓和出血等不良事件对预后的影响;新冠疫苗注射、类固醇皮质激素、抗病毒、抗细胞因子、单克隆抗体等对血栓形成风险的影响;亟需扩大样本量,进一步开展危重型COVID-19患者治疗剂量和预防剂量抗凝效果比较的高质量RCT研究。以上系列问题,仍然需要我们在后续的临床实践和研究中给予持续关注。
二、前景与展望
随着对疾病认识的深入和临床实践的进步,临床医生越来越重视COVID-19住院患者的VTE风险和抗凝干预,患者的总体预后进一步改善,但现有研究证据提示,在缺乏常规筛查的情况下,COVID-19患者真实的VTE发生率可能远超出我们的预期,尤其是收入ICU的危重型COVID-19住院患者[66, 140]。基于现有的循证医学证据,危重型患者仍应接受标准剂量的抗凝预防,出血风险低的中重型患者可能更容易从治疗剂量的抗凝预防中获益,但事实上,治疗剂量和预防剂量的适宜人群还需要在进一步的研究和临床实践中进行探索[44, 46]。
需要提出的是,本指南主要针对COVID-19住院患者,关于出院后的VTE评估和抗凝策略、随访与健康管理也进行了相对全面的阐述,详细推荐意见见图2。对于某些门、急诊患者,或居家观察和治疗的患者,也需要给予关注,建议加强健康宣教和科普宣传,必要时,可利用自评量表进行自我风险评估[141],并强化患者的生活方式干预和预防观念。但是,对这部分人群的抗凝管理策略,需要更多的循证医学证据。
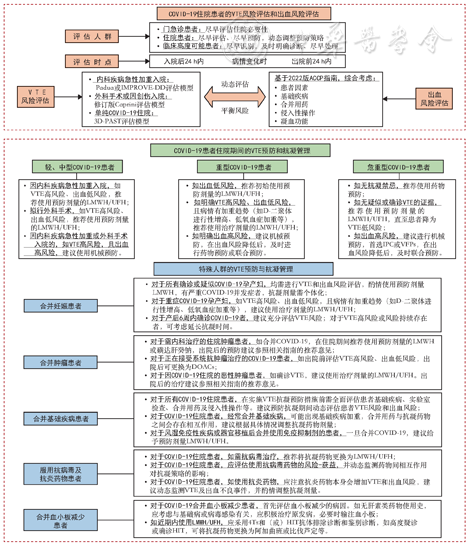
点击查看大图
图2
基于37条推荐意见的《新型冠状病毒感染住院患者血栓预防和抗凝管理路径图》

点击查看大图
图2
基于37条推荐意见的《新型冠状病毒感染住院患者血栓预防和抗凝管理路径图》
本指南适用于指导临床一线医护人员对COVID-19住院患者实施VTE的风险评估、预防以及出院后的抗凝管理。为了获取更强的循证医学证据,仍需要多学科、多领域的诸位同道勠力同心,不断拓展高质量的临床研究并进行系统的荟萃分析,包括开展一些RCT研究和真实世界研究。这些研究发现都有可能为临床实践提供更有价值的信息。随着新的临床研究的开展,包括住院前、住院期间以及出院后VTE抗凝预防效果评价等方面的循证医学证据会不断更新,本指南也会随之进行相应的动态调整。
《新型冠状病毒感染住院患者血栓预防和抗凝管理指南》工作组成员
顾问:王辰(中国医学科学院 北京协和医学院 呼吸病学研究院 国家呼吸医学中心);程显声(国家心血管病中心 中国医学科学院阜外医院);瞿介明(上海交通大学医学院附属瑞金医院);曹彬(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);乔人立(美国南加州大学医疗中心呼吸与危重症医学科);马旭东(国家卫生健康委员会医政司医疗质量与评价处)
指南制订组组长:王辰(中国医学科学院 北京协和医学院 呼吸病学研究院 国家呼吸医学中心)
执笔专家组 (按姓氏汉语拼音排序)
组长:翟振国(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心)
主要成员:程兆忠(青岛大学附属医院呼吸与危重症医学科);邓朝胜(福建医科大学附属第一医院呼吸与危重症医学科);高倩(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);黄强(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);季颖群(上海东方医院呼吸与危重症医学科);李承红(江汉大学附属医院呼吸与危重症医学科);李圣青(复旦大学附属华山医院呼吸与危重症医学科);刘锦铭(上海市肺科医院肺循环科);陆勇(上海交通大学医学院附属瑞金医院卢湾分院);门剑龙(天津医科大学总医院精准医学中心);瞿红(首都医科大学附属北京朝阳医院妇产科);时国朝(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);孙艺红(中日友好医院心脏科);覃伟(江汉大学附属医院呼吸与危重症医学科);陶禹至(吉林大学白求恩医学部);万钧(首都医科大学附属北京安贞医院呼吸与危重症医学科);王一民(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);夏磊(中日友好医院医务处 国家呼吸医学中心实验研究部);谢万木(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);熊长明(中国医学科学院阜外医院肺血管病诊治中心);许启霞(中国科学技术大学附属第一医院呼吸与危重症医学科);杨萌(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);杨媛华(首都医科大学附属北京朝阳医院呼吸与危重症医学科);易群(四川大学华西医院呼吸与危重症医学科);应可净(浙江大学医学院附属邵逸夫医院呼吸与危重症医学科);袁雅冬(河北医科大学第二医院呼吸与危重症医学科);张帅(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);张竹(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);朱玲(山东省立医院呼吸与危重症医学科)
讨论专家组(按姓氏汉语拼音排序)
组长:胡成平(中南大学湘雅医院呼吸与危重症医学科)
主要成员:陈虹(重庆医科大学附属第一医院呼吸与危重症医学科);陈文慧(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);程哲(郑州大学第一附属医院呼吸与危重症医学科);傅应云(深圳市人民医院呼吸与重症医学科);龚娟妮(首都医科大学附属北京朝阳医院呼吸与危重症医学科);郭璐(四川省人民医院呼吸与危重症医学科);侯刚(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);胡清华(华中科技大学同济医学院病理生理学系);贾存波(中日友好医院院办公室);姜红妮(复旦大学附属中山医院呼吸与危重症医学科);解卫平(江苏省人民医院呼吸与危重症医学科);刘维佳(贵州省人民医院呼吸与危重症医学科);刘先胜(山西白求恩医院呼吸与危重症医学科);罗琴(新疆医科大学附属肿瘤医院呼吸与危重症医学科);罗勤(中国医学科学院阜外医院肺血管病诊治中心);马壮(中国人民解放军北部战区总医院呼吸与危重症医学科);倪松石(南通大学附属医院呼吸与危重症医学科);施举红(中国医学科学院北京协和医院呼吸与危重症医学科);施熠炜(山西医科大学第一医院呼吸与危重症医学科);孙雪峰(中国医学科学院北京协和医院呼吸与危重症医学科);王岚(上海市肺科医院肺循环科);王胜锋(北京大学公共卫生学院);邢西迁(昆明医科大学附属延安医院呼吸与危重症医学科);杨沛然(中国医学科学院北京协和医学院基础医学研究所);杨汀(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);詹庆元(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);张静(北京大学第三医院呼吸与危重症医学科);张淑香(山东第一医科大学第一附属医院护理部)
外审专家组(按姓氏汉语拼音排序)
组长:刘鹏(中日友好医院心脏血管外科)
主要成员:白锋(兰州大学第二医院);陈丽(山西白求恩医院医务部);陈丽君(银川市第一人民医院呼吸与危重症医学科);陈颖(新疆维吾尔自治区人民医院呼吸与危重症医学科);陈忠(首都医科大学附属北京安贞医院血管外科);达娃(西藏第二人民医院);戴爱国(湖南中医药大学);董春玲(吉林大学第二医院呼吸与危重症医学科);董丽霞(天津医科大学总医院呼吸与危重症医学科);范晔(陆军军医大学第二附属医院呼吸与危重症医学科);符伟国(复旦大学附属中山医院血管外科);甘继瑞(中日友好医院教育处);关振鹏(北京大学首钢医院骨科);贺波(兰州大学第二医院医务科);洪城(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心 呼吸与危重症医学科);胡晓芸(山西医科大学第一医院呼吸与危重症医学科);冀冰心(首都医科大学宣武医院医务处);靳建军(郑州大学第一附属医院呼吸与危重症医学科);孔心娟(青岛大学附属医院);李嘉(首都医科大学宣武医院普通外科);李婧(内蒙古自治区人民医院医务处);李满祥(西安交通大学第一附属医院呼吸与危重症医学科);李小莹(首都医科大学宣武医院医务处);李晓冬(珠海市人民医院医务部);李玉英(中国人民解放军海军总医院呼吸与危重症医学科);刘春丽(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心 呼吸与危重症医学科);刘岽(上海交通大学医学院附属瑞金医院呼吸与危重症医学科);刘璠(中国医科大学附属第一医院呼吸与危重症医学科);刘晖(新疆医科大学第一附属医院呼吸与危重症医学科);刘建龙(北京积水潭医院血管外科);刘蕾(中国人民解放军北部战区总医院呼吸与重症医学科);刘莉(南方医科大学南方医院医疗质量管理科);刘双(北京大学国际医院呼吸与危重症医学科);柳志红(中国医学科学院阜外医院肺血管病诊治中心);马玉芬(中国医学科学院 北京协和医院工会);毛毅敏(河南科技大学第一附属医院呼吸与危重症医学科);美朗曲措(西藏自治区人民医院呼吸与危重症医学科);秦志强(广西壮族自治区人民医院呼吸与危重症医学科);史振宇(复旦大学附属中山医院血管外科);苏金霏(首都医科大学宣武医院耳鼻咽喉头颈外科);唐亮(华中科技大学同济医学院附属协和医院血液科);唐佩福(中国人民解放军总医院第一医学中心骨科);唐勇军(中南大学湘雅医院呼吸与危重症医学科);田红燕(西安交通大学医学院第一附属医院血管外科);王佳烈(内蒙古自治区人民医院呼吸与危重症医学科);王健(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心 呼吸疾病国家重点实验室);王宁(空军军医大学唐都医院消化内科);王薇(中日友好医院门诊办);王勇(北京市急救中心);王宗强(吉林大学中日联谊医院);吴琦(天津市海河医院呼吸与危重症医学科);伍姗姗(南昌大学第一附属医院医务处);夏书月(沈阳医学院附属中心医院呼吸与危重症医学科);辛世杰(中国医科大学附属第一医院血管外科);徐玲(重庆医科大学附属第一医院医务处);徐毛治(内蒙古自治区人民医院呼吸与危重症医学科);徐汝洪(东莞市人民医院呼吸与危重症医学科);徐伟(吉林大学第二医院呼吸与危重症医学科);徐喜媛(内蒙古医科大学第三附属医院内蒙古包钢医院呼吸与危重症医学科);许小毛(北京医院呼吸与危重症医学科);杨惠琴(新疆维吾尔自治区中医院呼吸与危重症医学科);杨涛(山西白求恩医院血管外科);应娇茜(中日友好医院医务处);张爱珍(山西省人民医院呼吸与危重症医学科);张挪富(广州医科大学附属第一医院 广州呼吸健康研究院 国家呼吸系统疾病临床医学研究中心 国家呼吸医学中心 呼吸与危重症医学科);张平(东莞市人民医院呼吸与危重症医学科);张坡(中国人民解放军北部战区总医院呼吸与重症医学科);张伟(广州中医药大学第一附属医院呼吸与危重症医学科);张伟华(中国人民解放军总医院第一医学中心呼吸与危重症医学科);张运剑(北京积水潭医院呼吸与危重症医学科);章锐锋(浙江大学医学院附属邵逸夫医院呼吸与危重症医学科);赵卉(安徽医科大学第二附属医院呼吸与危重症医学科);甄国华(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);朱光发(首都医科大学附属北京安贞医院呼吸与危重症医学科)
方法学和证据评价组(按姓氏汉语拼音排序)
组长:陈耀龙(兰州大学基础医学院循证医学中心 中国医学科学院循证评价与指南研究创新单元)
主要成员:陈意浓(北京大学中日友好临床医学院);李宜珊(山西医科大学第一医院);马双双(北京中医药大学);田瀚(中国医学科学院 北京协和医学院);王子君(兰州大学基础医学院循证医学中心 中国医学科学院循证评价与指南研究创新单元);张萌(首都医科大学附属北京安贞医院呼吸与危重症医学科);张云霞(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);张竹(中日友好医院呼吸中心 呼吸与危重症医学科 国家呼吸医学中心 国家呼吸系统疾病临床医学研究中心);周奇(兰州大学基础医学院循证医学中心 中国医学科学院循证评价与指南研究创新单元)
秘书组(按姓氏汉语拼音排序)
组长:夏磊(中日友好医院医务处 国家呼吸医学中心实验研究部)
主要成员:李煜晗(中南大学湘雅医学院);刘东(北京大学中日友好临床医学院);刘吉祥(中国医学科学院 北京协和医学院);覃伟(江汉大学附属医院呼吸与危重症医学科);陶禹至(吉林大学白求恩医学部);徐菲亚(首都医科大学);张晓萌(北京大学中日友好临床医学院);张宇(首都医科大学);甄凯元(北京大学中日友好临床医学院)
引用本文:
《新型冠状病毒感染住院患者血栓预防和抗凝管理指南》工作组, 中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 等. 新型冠状病毒感染住院患者血栓预防和抗凝管理指南[J]. 中华医学杂志, 2023, 103(12): 1-23. DOI: 10.3760/cma.j.cn112137-2023-01-20-00115.
利益冲突 利益冲突: 所有作者均声明无利益冲突
参考文献
[2]
HaematologyTL. COVID-19 coagulopathy: an evolving story[J]. Lancet Haematol, 2020, 7(6):e425. .
[3]
ConnorsJM, LevyJH. COVID-19 and its implications for thrombosis and anticoagulation[J]. Blood, 2020, 135(23):2033-2040. .
[4]
RenB, YanF, DengZ, et al. Extremely high incidence of lower extremity deep venous thrombosis in 48 patients with severe COVID-19 in Wuhan[J]. Circulation, 2020, 142(2):181-183. .
[5]
GuyattG, OxmanAD, AklEA, et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables[J]. J Clin Epidemiol, 2011, 64(4):383-394. .
[6]
陈耀龙, 姚亮, NorrisSusan, 等. GRADE在系统评价中应用的必要性及注意事项[J]. 中国循证医学杂志, 2013, 13(12):1401-1404. .
[8]
陈耀龙, 杨克虎, 王小钦, 等. 中国制订/修订临床诊疗指南的指导原则(2022版)[J]. 中华医学杂志, 2022, 102(10):697-703. .
[9]
ChenY, YangK, MarušicA, et al. A reporting tool for practice guidelines in health care: the RIGHT Statement[J]. Ann Intern Med, 2017, 166(2):128-132. .
[10]
BrouwersMC, KhoME, BrowmanGP, et al. AGREE Ⅱ: advancing guideline development, reporting and evaluation in health care[J]. CMAJ, 2010, 182(18):E839-842. .
[11]
National Institute for Health and Care Excellence (NICE).COVID-19 rapid guideline: reducing the risk of venous thromboembolism in over16s with COVID-19. [EB/OL]. [2023-01-28]. https://www.ncbi.nlm.nih.gov/books/NBK566720/.
[12]
GoldenbergNA, SochetA, AlbisettiM, et al. Consensus-based clinical recommendations and research priorities for anticoagulant thromboprophylaxis in children hospitalized for COVID-19-related illness[J]. J Thromb Haemost, 2020, 18(11):3099-3105. .
[13]
VogelJP, TendalB, GilesM, et al. Clinical care of pregnant and postpartum women with COVID-19: Living recommendations from the National COVID-19 Clinical Evidence Taskforce[J]. Aust N Z J Obstet Gynaecol, 2020, 60(6):840-851. .
[14]
ChekkalM, DebaT, HadjaliS, et al. Prevention and treatment of COVID-19-associated hypercoagulability: Recommendations of the Algerian society of transfusion and hemobiology[J]. Transfus Clin Biol, 2020, 27(4):203-206. .
[15]
KadirRA, KobayashiT, IbaT, et al. COVID-19 coagulopathy in pregnancy: critical review, preliminary recommendations, and ISTH registry-Communication from the ISTH SSC for Women′s Health[J]. J Thromb Haemost, 2020, 18(11):3086-3098. .
[16]
CostaA, WeinsteinES, SahooDR, et al. How to build the plane while flying: VTE/PE thromboprophylaxis clinical guidelines for COVID-19 patients[J]. Disaster Med Public Health Prep, 2020, 14(3):391-405. .
[17]
MooresLK, TritschlerT, BrosnahanS, et al. Prevention, diagnosis, and treatment of VTE in patients with coronavirus disease 2019: CHEST Guideline and Expert Panel Report[J]. Chest, 2020, 158(3):1143-1163. .
[18]
RamírezI, De la ViudaE, BaquedanoL, et al. Managing thromboembolic risk with menopausal hormone therapy and hormonal contraception in the COVID-19 pandemic: Recommendations from the Spanish Menopause Society, Sociedad Española de Ginecología y Obstetricia and Sociedad Española de Trombosis y Hemostasia[J]. Maturitas, 2020, 137:57-62. .
[19]
GerotziafasGT, CatalanoM, ColganMP, et al. Guidance for the management of patients with vascular disease or cardiovascular risk factors and COVID-19: position paper from vas-european independent foundation in angiology/vascular medicine[J]. Thromb Haemost, 2020, 120(12):1597-1628. .
[20]
RosovskyRP, GrodzinC, ChannickR, et al. Diagnosis and Treatment of Pulmonary Embolism During the Coronavirus Disease 2019 Pandemic: a position paper from the National PERT Consortium[J]. Chest, 2020, 158(6):2590-2601. .
[21]
PoliD, TosettoA, PalaretiG, et al. Managing anticoagulation in the COVID-19 era between lockdown and reopening phases[J]. Intern Emerg Med, 2020, 15(5):783-786. .
[22]
LoiM, BranchfordB, KimJ, et al. COVID-19 anticoagulation recommendations in children[J]. Pediatr Blood Cancer, 2020, 67(9):e28485. .
[23]
ZhaiZ, LiC, ChenY, et al. Prevention and treatment of venous thromboembolism associated with coronavirus disease 2019 infection: a consensus statement before guidelines[J]. Thromb Haemost, 2020, 120(6):937-948. .
[24]
KlugeS, MalinJJ, FichtnerF, et al. Clinical practice guideline: recommendations on the in-hospital treatment of patients with COVID-19[J]. Dtsch Arztebl Int, 2021, 118(50):865-871. .
[25]
IslamA, BashirMS, JoyceK, et al. An update on COVID-19 vaccine induced thrombotic thrombocytopenia syndrome and some management recommendations[J]. Molecules, 2021, 26(16).
[26]
KlugeS, JanssensU, SpinnerCD, et al. Clinical practice guideline: recommendations on inpatient treatment of patients with COVID-19[J]. Dtsch Arztebl Int, 2021, 118(Forthcoming):1-7. .
[27]
CukerA, TsengEK, NieuwlaatR, et al. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis in patients with COVID-19: May 2021 update on the use of intermediate-intensity anticoagulation in critically ill patients[J]. Blood Adv, 2021, 5(20):3951-3959. .
[28]
CukerA, TsengEK, NieuwlaatR, et al. American Society of Hematology 2021 guidelines on the use of anticoagulation for thromboprophylaxis in patients with COVID-19[J]. Blood Adv, 2021, 5(3):872-888. .
[29]
AhmedHY, PapaliA, HaileT, et al. Pragmatic recommendations for the management of anticoagulation and venous thrombotic disease for hospitalized patients with COVID-19 in low-and middle-income countries[J]. Am J Trop Med Hyg, 2021, 104(3_Suppl):99-109. .
[30]
Scottish Intercollegiate Guidelines Network (SIGN). Prevention and management of venous thromboembolism in COVID-19[EB/OL]. [2023-01-08].. http://www.sign.ac.uk
[32]
ChalmersJD, CrichtonML, GoeminnePC, et al. Management of hospitalised adults with coronavirus disease 2019 (COVID-19): a European Respiratory Society living guideline[J]. Eur Respir J, 2021, 57(4).
[33]
AntoniouKM, VasarmidiE, RussellAM, et al. European Respiratory Society statement on long COVID follow-up[J]. Eur Respir J, 2022, 60(2).
[34]
YamakawaK, YamamotoR, TerayamaT, et al. Japanese rapid/living recommendations on drug management for COVID-19: updated guidelines (July 2022)[J]. Acute Med Surg, 2022, 9(1):e789. .
[35]
BellinoS. COVID-19 treatments approved in the European Union and clinical recommendations for the management of non-hospitalized and hospitalized patients[J]. Ann Med, 2022, 54(1):2856-2860. .
[36]
WhiteH, McDonaldSJ, BarberB, et al. Care for adults with COVID-19: living guidelines from the National COVID-19 Clinical Evidence Taskforce[J]. Med J Aust, 2022, 217(7):368-378. .
[37]
SchulmanS, SholzbergM, SpyropoulosAC, et al. ISTH guidelines for antithrombotic treatment in COVID-19[J]. J Thromb Haemost, 2022, 20(10):2214-2225. .
[38]
FalavignaM, SteinC, AmaralJ, et al. Brazilian Guidelines for the pharmacological treatment of patients hospitalized with COVID-19: Joint guideline of Associação Brasileira de Medicina de Emergência, Associação de Medicina Intensiva Brasileira, Associação Médica Brasileira, Sociedade Brasileira de Angiologia e Cirurgia Vascular, Sociedade Brasileira de Infectologia, Sociedade Brasileira de Pneumologia e Tisiologia, Sociedade Brasileira de Reumatologia[J]. Rev Bras Ter Intensiva, 2022, 34(1):1-12. .
[39]
MooresLK, TritschlerT, BrosnahanS, et al. Thromboprophylaxis in patients with COVID-19: a brief update to the CHEST Guideline and Expert Panel Report[J]. Chest, 2022, 162(1):213-225. .
[40]
Fraile NavarroD, TendalB, TingayD, et al. Clinical care of children and adolescents with COVID-19: recommendations from the National COVID-19 Clinical Evidence Taskforce[J]. Med J Aust, 2022, 216(5):255-263. .
[41]
FargeD, FrereC, ConnorsJM, et al. 2022 international clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer, including patients with COVID-19[J]. Lancet Oncol, 2022, 23(7):e334-e347. .
[42]
CukerA, TsengEK, NieuwlaatR, et al. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis in patients with COVID-19: July 2021 update on postdischarge thromboprophylaxis[J]. Blood Adv, 2022, 6(2):664-671. .
[43]
VanasscheT, OrlandoC, VandenboschK, et al. Belgian clinical guidance on anticoagulation management in hospitalised and ambulatory patients with COVID-19[J]. Acta Clin Belg, 2022, 77(2):280-285. .
[44]
CukerA, TsengEK, SchünemannHJ, et al. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis for patients with COVID-19: March 2022 update on the use of anticoagulation in critically ill patients[J]. Blood Adv, 2022, 6(17):4975-4982. .
[45]
BarnesGD, BurnettA, AllenA, et al. Thromboembolic prevention and anticoagulant therapy during the COVID-19 pandemic: updated clinical guidance from the anticoagulation forum[J]. J Thromb Thrombolysis, 2022, 54(2):197-210. .
[46]
CukerA, TsengEK, NieuwlaatR, et al. American Society of Hematology living guidelines on the use of anticoagulation for thromboprophylaxis in patients with COVID-19: January 2022 update on the use of therapeutic-intensity anticoagulation in acutely ill patients[J]. Blood Adv, 2022, 6(17):4915-4923. .
[47]
马玉芬, 邓海波, 王晓杰, 等. 成人新型冠状病毒肺炎患者静脉血栓栓塞症防控护理专家共识[J]. 中华护理杂志, 2020, 55(5):666-670. .
[48]
毕娜, 付小洁, 高远, 等. 新型冠状病毒肺炎合并骨创伤患者静脉血栓栓塞症防治的护理建议[J]. 中华创伤杂志, 2020, 36(3):197-201. .
[49]
中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组, 等. 新型冠状病毒肺炎相关静脉血栓栓塞症防治建议(试行)[J]. 中华医学杂志, 2020, 100(11):808-813. .
[50]
蒋岚杉, 王雪钢, 王成, 等. 新型冠状病毒肺炎危重患者院内静脉血栓栓塞症防控的同质化管理[J]. 中华血管外科杂志, 2020, 5(1):14-16. .
[51]
湖北省医学会心血管病学分会, 湖北省急性心血管疾病医疗救治中心. 新型冠状病毒感染防疫期间急性心血管疾病救治专家建议[J]. 临床内科杂志, 2020, 37(3):211-214. .
[52]
熊堉, 边原, 蒋敏, 等. 新型冠状病毒肺炎相关静脉血栓防治的药学服务[J]. 中国医院药学杂志, 2020, 40(8):857-863. .
[53]
郝军舰, 冯智明, 谢铭, 等. 新型冠状病毒肺炎相关深静脉血栓防治建议[J]. 青海医药杂志, 2021, 51(2):39-42.
[54]
SheaBJ, GrimshawJM, WellsGA, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews[J]. BMC Med Res Methodol, 2007, 7:10. .
[55]
HigginsJP, AltmanDG, GøtzschePC, et al. The Cochrane Collaboration′s tool for assessing risk of bias in randomised trials[J]. BMJ, 2011, 343:d5928. .
[56]
WhitingPF, RutjesAW, WestwoodME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8):529-536. .
[58]
VernooijRW, SanabriaAJ, SolàI, et al. Guidance for updating clinical practice guidelines: a systematic review of methodological handbooks[J]. Implement Sci, 2014, 9:3. .
[59]
VernooijRW, Alonso-CoelloP, BrouwersM, et al. Reporting items for updated clinical guidelines: checklist for the reporting of updated guidelines (CheckUp)[J]. PLoS Med, 2017, 14(1):e1002207. .
[60]
Di MinnoA, AmbrosinoP, CalcaterraI, et al. COVID-19 and venous thromboembolism: a Meta-analysis of literature studies[J]. Semin Thromb Hemost, 2020, 46(7):763-771. .
[61]
DeitelzweigS, LuoX, NguyenJL, et al. Thrombotic and bleeding events, mortality, and anticoagulant use among 546, 656 hospitalized patients with COVID-19 in the United States: a retrospective cohort study[J]. J Thromb Thrombolysis, 2022, 53(4):766-776. .
[62]
FauvelC, WeizmanO, TrimailleA, et al. Pulmonary embolism in COVID-19 patients: a French multicentre cohort study[J]. Eur Heart J, 2020, 41(32):3058-3068. .
[63]
WhyteMB, KellyPA, GonzalezE, et al. Pulmonary embolism in hospitalised patients with COVID-19[J]. Thromb Res, 2020, 195:95-99. .
[64]
ChenS, ZhangD, ZhengT, et al. DVT incidence and risk factors in critically ill patients with COVID-19[J]. J Thromb Thrombolysis, 2021, 51(1):33-39. .
[65]
ZhangL, FengX, ZhangD, et al. Deep vein thrombosis in hospitalized patients with COVID-19 in Wuhan, China: prevalence, risk factors, and outcome[J]. Circulation, 2020, 142(2):114-128. .
[66]
WichmannD, SperhakeJP, LütgehetmannM, et al. Autopsy findings and venous thromboembolism in patients With COVID-19: a prospective cohort study[J]. Ann Intern Med, 2020, 173(4):268-277. .
[67]
ConwayEM, PryzdialE. Is the COVID-19 thrombotic catastrophe complement-connected?[J]. J Thromb Haemost, 2020, 18(11):2812-2822. .
[68]
KlokFA, KruipM, van der MeerN, et al. Incidence of thrombotic complications in critically ill ICU patients with COVID-19[J]. Thromb Res, 2020, 191:145-147. .
[69]
CarsanaL, SonzogniA, NasrA, et al. Pulmonary post-mortem findings in a series of COVID-19 cases from northern Italy: a two-centre descriptive study[J]. Lancet Infect Dis, 2020, 20(10):1135-1140. .
[70]
MenterT, HaslbauerJD, NienholdR, et al. Postmortem examination of COVID-19 patients reveals diffuse alveolar damage with severe capillary congestion and variegated findings in lungs and other organs suggesting vascular dysfunction[J]. Histopathology, 2020, 77(2):198-209. .
[71]
LiH, LiuL, ZhangD, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses[J]. Lancet, 2020, 395(10235):1517-1520. .
[72]
TalasazAH, SadeghipourP, KakavandH, et al. Recent randomized trials of antithrombotic therapy for patients with COVID-19: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2021, 77(15):1903-1921. .
[73]
AltschulDJ, UndaSR, de La Garza RamosR, et al. Hemorrhagic presentations of COVID-19: risk factors for mortality[J]. Clin Neurol Neurosurg, 2020, 198:106112. .
[74]
ArachchillageD, LaffanM. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia[J]. J Thromb Haemost, 2020, 18(5):1233-1234. .
[75]
HenryBM, VikseJ, BenoitS, et al. Hyperinflammation and derangement of renin-angiotensin-aldosterone system in COVID-19: A novel hypothesis for clinically suspected hypercoagulopathy and microvascular immunothrombosis[J]. Clin Chim Acta, 2020, 507:167-173. .
[76]
KatsoularisI, Fonseca-RodríguezO, FarringtonP, et al. Risks of deep vein thrombosis, pulmonary embolism, and bleeding after covid-19: nationwide self-controlled cases series and matched cohort study[J]. BMJ, 2022, 377:e069590. .
[78]
Guillermo-EspositoC, CasaisP, Cesarman-MausG, et al. [Guidelines for prophylaxis and anti-thrombotic treatment for patients with COVID-19. Consensus of the Latin American Cooperative Group on Hemostasis and Thrombosis (CLAHT)][J]. Arch Cardiol Mex, 2021, 91(Suplemento COVID):047-054. .
[79]
LeeY, JehangirQ, LinCH, et al. 3D-PAST: risk assessment model for predicting venous thromboembolism in COVID-19[J]. J Clin Med, 2022, 11(14).
[80]
GoldinM, LinSK, KohnN, et al. External validation of the IMPROVE-DD risk assessment model for venous thromboembolism among inpatients with COVID-19[J]. J Thromb Thrombolysis, 2021, 52(4):1032-1035. .
[81]
TsaplinS, SchastlivtsevI, ZhuravlevS, et al. The original and modified Caprini score equally predicts venous thromboembolism in COVID-19 patients[J]. J Vasc Surg Venous Lymphat Disord, 2021, 9(6):1371-1381.e4. .
[82]
LucijanicM, JurinI, Sedinic LackoM, et al. Comparison of IMPROVE, modified IMPROVE, IMPROVEDD, Padua and CHA2DS2-VASC risk scores for venous and arterial thrombotic events prediction in hospitalized COVID-19 patients[J]. Thromb Res, 2022, 214:37-39. .
[83]
ZengDX, XuJL, MaoQX, et al. Association of Padua prediction score with in-hospital prognosis in COVID-19 patients[J]. QJM, 2020, 113(11):789-793. .
[84]
ChenS, ZhengT, WangS, et al. Association between risk of venous thromboembolism and mortality in patients with COVID-19[J]. Int J Infect Dis, 2021, 108:543-549. .
[85]
PazRios LH, MingaI, KwakE, et al. Prognostic value of venous thromboembolism risk assessment models in patients with severe COVID-19[J]. TH Open, 2021, 5(2):e211-e219. .
[86]
全国肺栓塞和深静脉血栓形成防治能力建设项目专家委员会《医院内静脉血栓栓塞症防治质量评价与管理指南(2022版)》编写专家组. 医院内静脉血栓栓塞症防治质量评价与管理指南(2022版)[J]. 中华医学杂志, 2022, 102(42):3338-3348. .
[88]
CohenSL, GianosE, BarishMA, et al. Prevalence and predictors of venous thromboembolism or mortality in hospitalized COVID-19 patients[J]. Thromb Haemost, 2021, 121(8):1043-1053. .
[89]
NoppS, MoikF, JilmaB, et al. Risk of venous thromboembolism in patients with COVID-19: A systematic review and meta-analysis[J]. Res Pract Thromb Haemost, 2020, 4(7):1178-1191. .
[90]
TalS, SpectreG, KornowskiR, et al. Venous thromboembolism complicated with COVID-19: what do we know so far?[J]. Acta Haematol, 2020, 143(5):417-424. .
[91]
ThomasMR, ScullyM. Clinical features of thrombosis and bleeding in COVID-19[J]. Blood, 2022, 140(3):184-195. .
[92]
LiuY, CaiJ, WangC, et al. A systematic review and meta-analysis of incidence, prognosis, and laboratory indicators of venous thromboembolism in hospitalized patients with coronavirus disease 2019[J]. J Vasc Surg Venous Lymphat Disord, 2021, 9(5): 1099-1111 e6.
[93]
NicholsonM, ChanN, BhagirathV, et al. Prevention of venous thromboembolism in 2020 and beyond[J]. J Clin Med, 2020, 9(8).
[94]
SholzbergM, TangGH, RahhalH, et al. Effectiveness of therapeutic heparin versus prophylactic heparin on death, mechanical ventilation, or intensive care unit admission in moderately ill patients with covid-19 admitted to hospital: RAPID randomised clinical trial[J]. BMJ, 2021, 375:n2400. .
[95]
Marcos-JubilarM, Carmona-TorreF, VidalR, et al. Therapeutic versus prophylactic bemiparin in hospitalized patients with nonsevere COVID-19 pneumonia (BEMICOP Study): An Open-Label, Multicenter, Randomized, Controlled Trial[J]. Thromb Haemost, 2022, 122(2):295-299. .
[96]
MoriciN, PoddaG, BirocchiS, et al. Enoxaparin for thromboprophylaxis in hospitalized COVID-19 patients: The X-COVID-19 Randomized Trial[J]. Eur J Clin Invest, 2022, 52(5):e13735. .
[98]
中华医学会呼吸病学分会肺栓塞与肺血管病学组, 中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会, 全国肺栓塞与肺血管病防治协作组. 肺血栓栓塞症诊治与预防指南[J]. 中华医学杂志, 2018, 98(14):1060-1087. .
[99]
KlokFA, AgenoW, AyC, et al. Optimal follow-up after acute pulmonary embolism: a position paper of the European Society of Cardiology Working Group on Pulmonary Circulation and Right Ventricular Function, in collaboration with the European Society of Cardiology Working Group on Atherosclerosis and Vascular Biology, endorsed by the European Respiratory Society[J]. Eur Heart J, 2022, 43(3):183-189. .
[100]
GarciaDA, BaglinTP, WeitzJI, et al. Parenteral anticoagulants: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines[J]. Chest, 2012, 141(2Suppl):e24S-e43S. .
[101]
KonstantinidesSV, MeyerG, BecattiniC, et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS)[J]. Eur Heart J, 2020, 41(4):543-603. .
[102]
KyriakoulisKG, DimakakosE, KyriakoulisIG, et al. Practical recommendations for optimal thromboprophylaxis in patients with COVID-19: a consensus statement based on available clinical trials[J]. J Clin Med, 2022, 11(20).
[103]
BikdeliB, MadhavanMV, JimenezD, et al. COVID-19 and thrombotic or thromboembolic disease: implications for prevention, antithrombotic therapy, and follow-up: JACC state-of-the-art review[J]. J Am Coll Cardiol, 2020, 75(23):2950-2973. .
[104]
中国临床肿瘤学会肿瘤与血栓专家委员会. 肿瘤相关静脉血栓栓塞症预防与治疗指南(2019版)[J]. 中国肿瘤临床, 2019, 46(13):653-660. .
[105]
MangiaficoM, CaffA, CostanzoL. The role of heparin in COVID-19: an update after two years of pandemics[J]. J Clin Med, 2022, 11(11).
[106]
SadeghipourP, TalasazAH, RashidiF, et al. Effect of intermediate-dose vs standard-dose prophylactic anticoagulation on thrombotic events, extracorporeal membrane oxygenation treatment, or mortality among patients with COVID-19 admitted to the intensive care unit: the INSPIRATION randomized clinical trial[J]. JAMA, 2021, 325(16):1620-1630. .
[107]
BikdeliB, TalasazAH, RashidiF, et al. Intermediate-dose versus standard-dose prophylactic anticoagulation in patients with COVID-19 admitted to the intensive care unit: 90-day results from the INSPIRATION randomized trial[J]. Thromb Haemost, 2022, 122(1):131-141. .
[108]
PerepuUS, ChambersI, WahabA, et al. Standard prophylactic versus intermediate dose enoxaparin in adults with severe COVID-19: A multi-center, open-label, randomized controlled trial[J]. J Thromb Haemost, 2021, 19(9):2225-2234. .
[109]
GoligherEC, BradburyCA, McVerryBJ, et al. Therapeutic anticoagulation with heparin in critically ill patients with Covid-19[J]. N Engl J Med, 2021, 385(9):777-789. .
[110]
SpyropoulosAC, GoldinM, GiannisD, et al. Efficacy and safety of therapeutic-dose heparin vs standard prophylactic or intermediate-dose heparins for thromboprophylaxis in high-risk hospitalized patients with COVID-19: the hep-COVID randomized clinical trial[J]. JAMA Intern Med, 2021, 181(12):1612-1620. .
[111]
SridharanGK, VeguntaR, RokkamV, et al. Venous thromboembolism in hospitalized COVID-19 patients[J]. Am J Ther, 2020, 27(6):e599-e610. .
[112]
LawlerPR, GoligherEC, BergerJS, et al. Therapeutic anticoagulation with heparin in noncritically ill patients with Covid-19[J]. N Engl J Med, 2021, 385(9):790-802. .
[113]
JacksonE, CurtisKM, GaffieldME. Risk of venous thromboembolism during the postpartum period: a systematic review[J]. Obstet Gynecol, 2011, 117(3):691-703. .
[114]
PapageorghiouAT, DeruelleP, GunierRB, et al. Preeclampsia and COVID-19: results from the INTERCOVID prospective longitudinal study[J]. Am J Obstet Gynecol, 2021, 225(3):289.e1-289.e17. .
[116]
MetzTD, CliftonRG, HughesBL, et al. Disease severity and perinatal outcomes of pregnant patients with coronavirus disease 2019 (COVID-19)[J]. Obstet Gynecol, 2021, 137(4):571-580. .
[117]
GreerIA, Nelson-PiercyC. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy[J]. Blood, 2005, 106(2):401-407. .
[118]
JiménezD, García-SanchezA, RaliP, et al. Incidence of VTE and bleeding among hospitalized patients with coronavirus disease 2019: a systematic review and meta-analysis[J]. Chest, 2021, 159(3):1182-1196. .
[119]
BischS, FindleyR, InceC, et al. Efficacy of pre-operative pharmacologic thromboprophylaxis on incidence of venous thromboembolism following major gynecologic and gynecologic oncology surgery: a systematic review and meta-analysis[J]. Int J Gynecol Cancer, 2021, 31(2):257-264. .
[120]
ZwickerJI, RoopkumarJ, PuligandlaM, et al. Dose-adjusted enoxaparin thromboprophylaxis in hospitalized cancer patients: a randomized, double-blinded multicenter phase 2 trial[J]. Blood Adv, 2020, 4(10):2254-2260. .
[121]
BoschF, MulderFI, KamphuisenPW, et al. Primary thromboprophylaxis in ambulatory cancer patients with a high Khorana score: a systematic review and meta-analysis[J]. Blood Adv, 2020, 4(20):5215-5225. .
[122]
InsinP, VitoopinyoparbK, ThadaniponK, et al. Prevention of venous thromboembolism in gynecological cancer patients undergoing major abdominopelvic surgery: A systematic review and network meta-analysis[J]. Gynecol Oncol, 2021, 161(1):304-313. .
[123]
GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet. 2018, 392(10159):1736-1788. .
[124]
BasuS. Non-communicable disease management in vulnerable patients during Covid-19[J]. Indian J Med Ethics, 2020, V(2):103-105. .
[125]
LaxSF, SkokK, ZechnerP, et al. Pulmonary arterial thrombosis in COVID-19 with fatal outcome: results from a prospective, single-center, clinicopathologic case series[J]. Ann Intern Med, 2020, 173(5):350-361. .
[126]
AsiimweIG, PushpakomSP, TurnerRM, et al. Cardiovascular drugs and COVID-19 clinical outcomes: a systematic review and meta-analysis of randomized controlled trials[J]. Br J Clin Pharmacol, 2022, 88(8):3577-3599. .
[127]
YeC, ZhongJ, CaiS, et al. COVID-19 infection in patients with connective tissue disease: a multicity study in Hubei province, China[J]. MedComm (2020), 2021, 2(1):82-90. .
[128]
HammondJ, Leister-TebbeH, GardnerA, et al. Oral nirmatrelvir for high-risk, nonhospitalized adults with Covid-19[J]. N Engl J Med, 2022, 386(15):1397-1408. .
[129]
LemaitreF, GrégoireM, MonchaudC, et al. Management of drug-drug interactions with nirmatrelvir/ritonavir in patients treated for Covid-19: Guidelines from the French Society of Pharmacology and Therapeutics (SFPT)[J]. Therapie, 2022, 77(5):509-521. .
[130]
MarzoliniC, KuritzkesDR, MarraF, et al. Recommendations for the management of drug-drug interactions between the COVID-19 Antiviral Nirmatrelvir/Ritonavir (Paxlovid) and comedications[J]. Clin Pharmacol Ther, 2022, 112(6):1191-1200. .
[131]
ValgimigliM, BuenoH, ByrneRA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS)[J]. Eur Heart J, 2018, 39(3):213-260. .
[132]
YuB, ChangJ. The first Chinese oral anti-COVID-19 drug Azvudine launched[J]. Innovation (Camb), 2022, 3(6):100321. .
[133]
SinghAK, SinghA, SinghR, et al. Molnupiravir in COVID-19: a systematic review of literature[J]. Diabetes Metab Syndr, 2021, 15(6):102329. .
[134]
BradyDK, GurijalaAR, HuangL, et al. A guide to COVID-19 antiviral therapeutics: a summary and perspective of the antiviral weapons against SARS-CoV-2 infection[J]. FEBS J, 2022, .
[135]
CukerA, ArepallyGM, ChongBH, et al. American Society of Hematology 2018 guidelines for management of venous thromboembolism: heparin-induced thrombocytopenia[J]. Blood Adv, 2018, 2(22):3360-3392. .
[136]
GiannisD, AllenSL, TsangJ, et al. Postdischarge thromboembolic outcomes and mortality of hospitalized patients with COVID-19: the CORE-19 registry[J]. Blood, 2021, 137(20):2838-2847. .
[137]
LuiD, LiYK, LeeCH, et al. A prospective study of the impact of glycaemic status on clinical outcomes and anti-SARS-CoV-2 antibody responses among patients with predominantly non-severe COVID-19[J]. Diabetes Res Clin Pract, 2022, 185:109232. .
[138]
RamacciottiE, Barile AgatiL, CalderaroD, et al. Rivaroxaban versus no anticoagulation for post-discharge thromboprophylaxis after hospitalisation for COVID-19 (MICHELLE): an open-label, multicentre, randomised, controlled trial[J]. Lancet, 2022, 399(10319):50-59. .
[139]
BradburyCA, LawlerPR, StanworthSJ, et al. Effect of antiplatelet therapy on survival and organ support-free days in critically ill patients with COVID-19: A Randomized Clinical Trial[J]. JAMA, 2022, 327(13):1247-1259. .
[140]
AckermannM, VerledenSE, KuehnelM, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19[J]. N Engl J Med, 2020, 383(2):120-128. .
[141]
ZhangZ, WuY, LiuQ, et al. Patient-completed caprini risk score for venous thromboembolism risk assessment: developed and validated from 1, 017 medical and surgical patients[J]. TH Open, 2022, 6(3):e184-e193. .



